2024-09-20 分类:ai文献综述
阅读(73) 评论(0)
10.1016/j.brachy.2023.04.003
目的: 人工智能(AI)具有简化和优化近距离治疗工作流程各个步骤的潜力。本文综述旨在概述在该领域中所做的工作。
方法和材料: 我们在2022年6月在PubMed、Embase和Cochrane上进行文献搜索,寻找AI在近距离治疗中应用的论文。
结果: 共有80篇论文符合纳入/排除标准。这些论文按照以下方式分类:分割(24篇)、配准和图像处理(6篇)、预计划(13篇)、剂量预测和治疗计划(11篇)、施源器/导管/针的重建(16篇)和质量保证(10篇)。AI技术范围从经典模型(如支持向量机和基于决策树的学习)到较新的技术(如U-Net和深度强化学习),应用于单个流程(例如优化施源器选择)甚至自动化整个工作流程的步骤(例如端到端预计划)。许多算法达到了人类水平,并显著的提升了速度。
结论: AI具有增强、自动化和/或加速近距离治疗工作流程的潜力。我们建议未来的研究遵守标准的报告指南。我们还强调使用更大的样本量和使用临床可解释的指标报告结果的重要性。
近距离放射治疗是一个基于证据的治疗方法,对于泌尿生殖系统和妇科恶性肿瘤的管理至关重要。它是前列腺癌、宫颈癌和子宫内膜癌治疗的基石,并在适当使用时与预后改善有关。然而,尽管有大量支持其使用的证据,近距离放射治疗并不广泛适用于所有患者。但是,与其他治疗方法相比,它具有一些独特的优势,这使得它成为特定患者群体中的首选治疗方法。与外照射放射治疗(EBRT)相比,近距离放疗需要更多资源,需要设备和专业知识,这些可能并不广泛可得。
近年来,人工智能(AI)在自动化和增强近距离放疗工作流程的几个步骤方面引起了越来越多的兴趣。AI的使用已经在医学领域产生了转变,也正在改变放射肿瘤学的格局。在EBRT的背景下,AI最广泛研究的应用领域是自动分割和自动治疗计划,这两个应用都在时间节省和计划质量方面改善了手动工作流程。鉴于这些方法的成功,AI的自动分割和自动计划越来越多地融入商业肿瘤学信息系统(OIS)并在放射肿瘤学临床实践中应用。
虽然EBRT的一些AI应用可以应用于近距离治疗,但工作流程上存在根本性的差异,需要单独研究如何最佳地利用AI在近距离治疗中。例如,在前列腺癌中,EBRT中分割的主要成像模态是计算机断层扫描(CT),而在近距离治疗中,超声(U/S)是最常用的,同时由于针或粒子的存在可能会导致图像质量下降,可能会出现更多的挑战。另一方面,EBRT和近距离治疗中可用于训练的数据集存在潜在差异。虽然不同机构之间放射治疗方案和工作流程通常会有一定的变异,但近距离治疗还涉及与操作技术相关的其他复杂问题,这可能会给基于AI方法的泛化能力带来更多的挑战。
认识到AI在优化和简化近距离治疗工作流程方面的巨大潜力,这可能会增加这种重要治疗的普及性和治疗质量,最近有几个团体发表了有关在近距离治疗过程中使用AI的特定步骤的文章。在本报告中,我们旨在总结当前文献中关于如何应用AI解决这些问题的情况。主要关注在前列腺癌和宫颈癌近距离治疗中的应用,我们将这些论文分类为近距离治疗工作流程的相应步骤。我们讨论这些论文中详细描述的方法和结果,确定领域中存在的空白,并提出未来的研究方向。
2022年6月,在PubMed、Embase和Cochrane上进行搜索,使用的搜索词是“(人工智能或机器学习或深度学习)和Brachytherapy”。这些摘要根据以下的入选和排除标准进行了筛选:所包含的论文必须是用英语撰写的,并涉及将人工智能、机器学习或深度学习应用于Brachytherapy工作流的某个步骤。回顾性论文、编辑文章和会议摘要被排除在外。在筛选过程中,还参考了论文的参考文献清单,以寻找可能符合入选/排除标准的其他论文。筛选由两位独立的审阅者完成,冲突通过讨论解决。最终纳入的论文被分为以下几类:自动分割、图像配准和图像处理、预计划、剂量预测和治疗计划、施源器/导管/插植针重建,以及质量保证。
初步搜索共检索到418篇(排除重复项)。其中65篇论文符合包含和排除标准。从我们的参考文献列表中,筛查了118篇引用文献,并包括了其中的15篇论文。因此,本研究共纳入了80篇论文。表1总结了近距离治疗工作流程每个步骤所确定的论文,图1展示了每个步骤找到的论文数量。图2描述了文献检索和筛选过程。以下小节详细介绍了每个步骤所找到的放射治疗工作流程的论文结果。
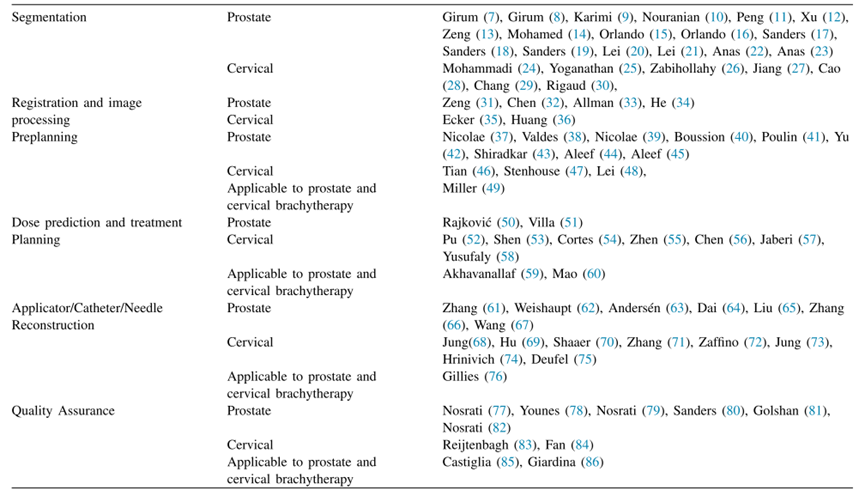
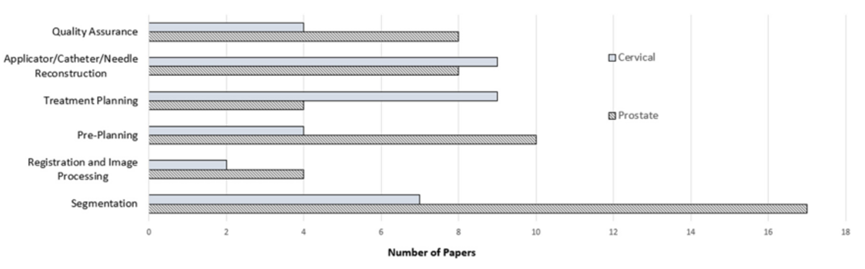
图1.条形图显示了此文献综述在近距离治疗工作流程的每个步骤中确定的人工智能出版物数量。
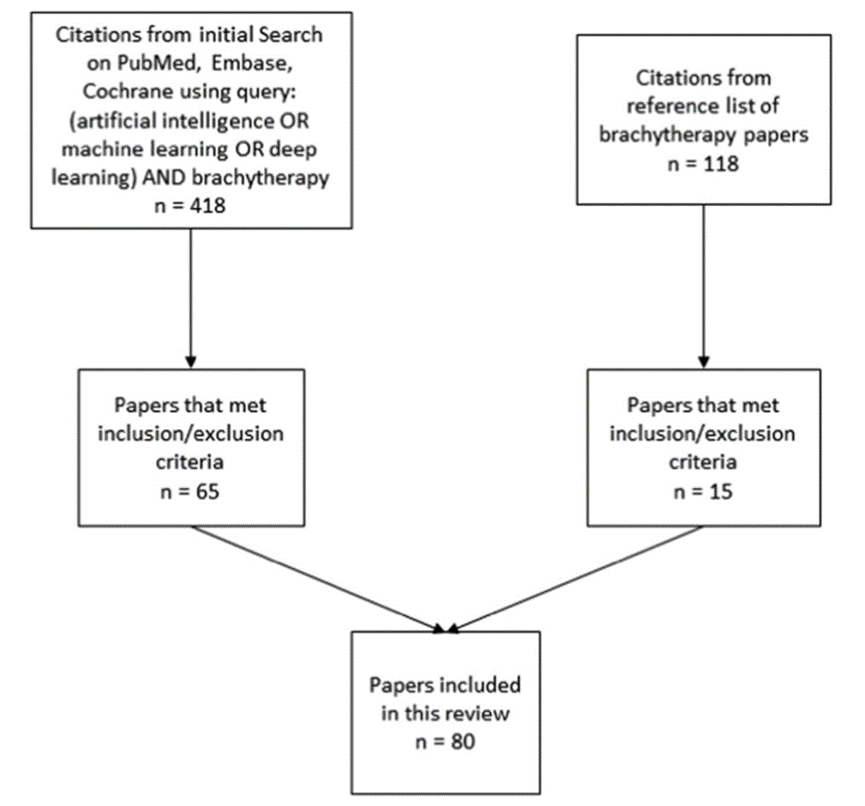
图2.流程图描述了文献综述过程中每个步骤中确定的论文数量。
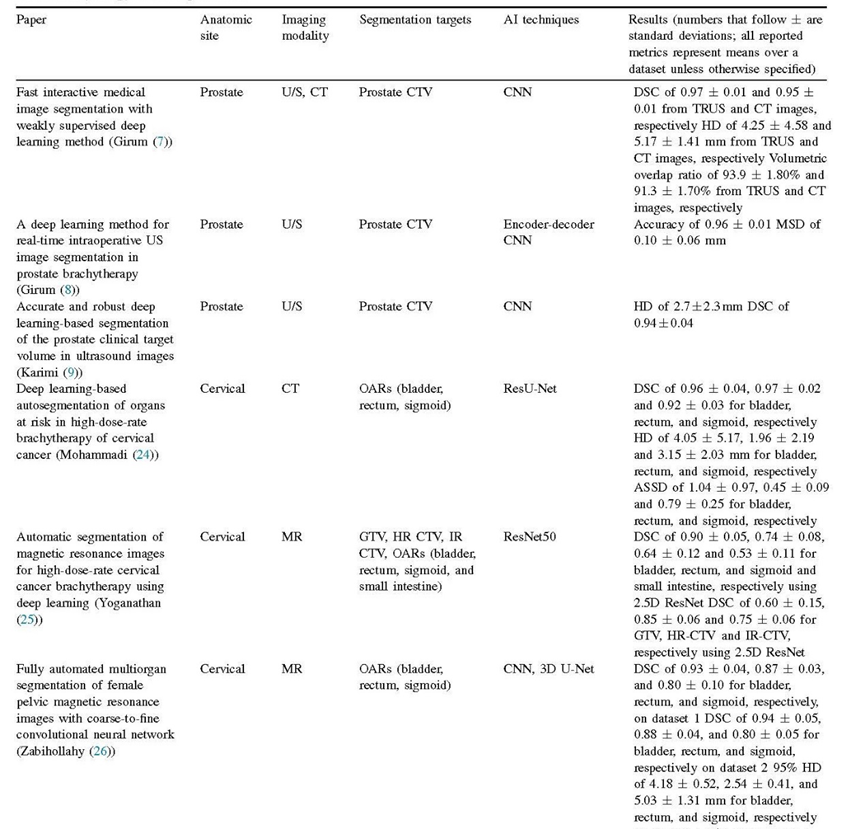
在我们搜索近距离治疗中人工智能应用的大部分工作中,大部分都属于分割类别。分割是治疗计划和图像配准等任务所必需的基本任务。在低剂量率(LDR)放射治疗术前计划工作流中,通常使用超声图像对前列腺进行分割,并确定治疗所使用的放射性粒子数量,以及插植针/粒子位置和粒子强度。在LDR的术中计划工作流中,计划是实时进行的,并且剂量测定持续更新。任何偏差可能需要在线调整计划,例如改变粒子布局。放置后通常进行成像和分割,以评估植入质量。大多数高剂量率(HDR)前列腺工作流使用术中计划,根据插植针的位置以及分割的靶区和危及器官(OARs)生成治疗计划。
准确的靶区和其他器官的分割对剂量计算的准确性以及治疗计划的质量和安全性非常重要。由于器官大小和形状的变化、超声产生的伪影、粒子和插植针产生的伪影、器官边界的对比度低以及缺乏图像标志(特别是在前列腺的底部和顶部),分割具有挑战性。手动分割可能耗时、乏味且容易出现变异。基于人工智能的分割是为了实现可重复性(减少观察者间的变异性)和速度而发展起来。此外,近年来,在前列腺近距离治疗中越来越多地使用磁共振成像(MRI),因为它具有优越的软组织对比度。出现了许多关于基于人工智能的MRI图像分割在近距离治疗中的论文。在宫颈癌近距离治疗中,通常使用MRI或CT成像进行分割。与前列腺放射治疗类似,准确地勾画靶区和OAR对于准确的剂量计算是至关重要的。因此,人工智能分割的动机是相似的。在粒子植入术中计划和HDR工作流中,速度尤为重要,因为患者的时间有限。
此外,近年来由于其出色的软组织对比度(87-89),磁共振成像(MRI)在前列腺粒子植入放射治疗中的使用越来越多。这得到了基于人工智能的磁共振图像分割的研究支持,表1中展示了相关的论文。在宫颈癌近距离放射治疗中,通常使用MRI或CT成像进行分割。与前列腺粒子植入类似,准确定位靶区和危及器官对于剂量计算至关重要,因此基于人工智能的分割具有相似的动机(24)。
在粒子植入的术中和高剂量率工作流中速度尤为重要,因为患者扫描和治疗之间的时间有限。我们发现,人工智能的性能似乎至少与人类专家一样出色,并且在分割速度上提供了显著的提升。例如,Jiang等人的深度学习模型RefineNet能够为宫颈癌近距离放射治疗勾画出临床靶体积(CTV)和危及器官。RefineNet在性能评估指标(Dice相似度、Hausdorff距离、重叠指数)上超过了手动分割,并且所需时间约为人类专家的40%(27)。类似地,Orlando等人的U-Net ++模型在前列腺三维超声分割中达到了最高94.5%的Dice相似度系数,所需时间仅为1.33秒,而手动分割需要长达20分钟(16)。我们在表2中总结了应用人工智能进行分割的研究工作,这些研究通常表明在匹配人类性能方面取得了类似的结果,同时在速度上有显著的提升。
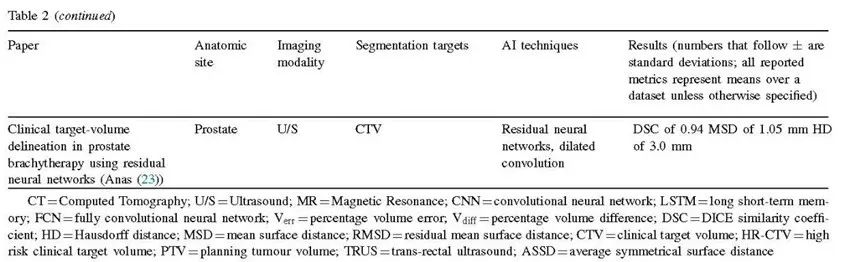
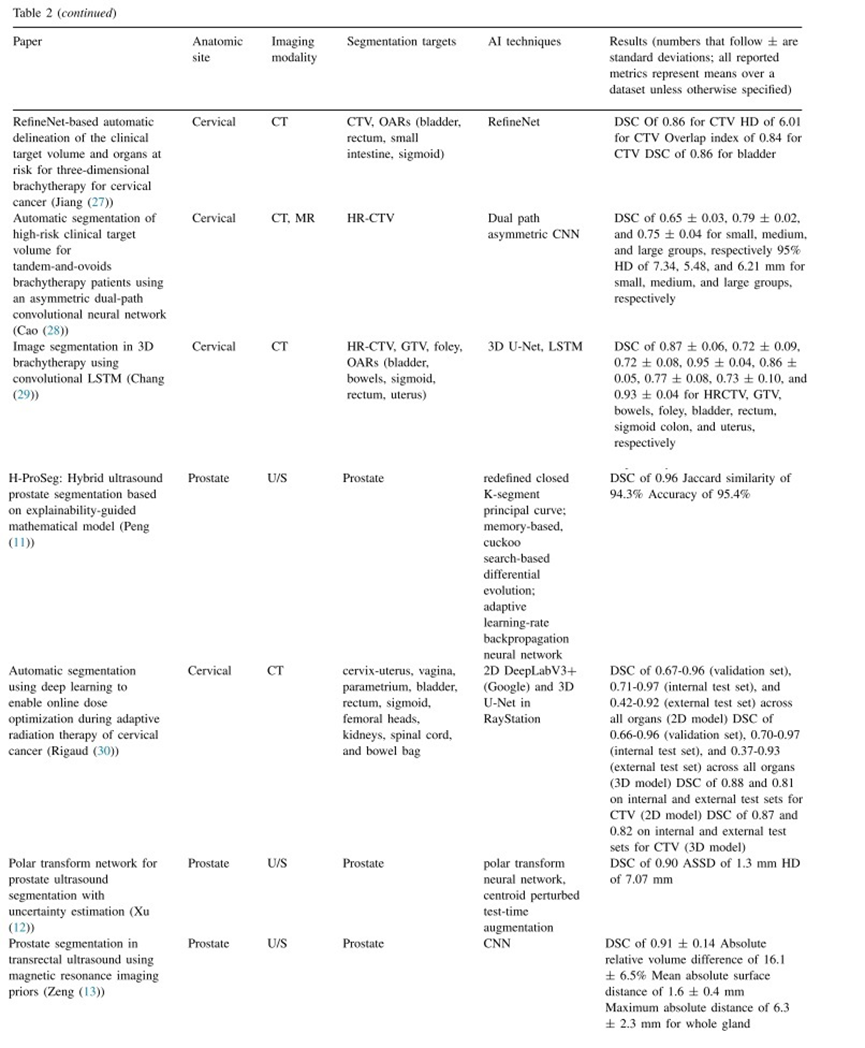
图像配准是将不同图像集合并到同一参考坐标中的过程。在HDR前列腺近距离治疗中,图像配准通常在治疗过程中使用。由于其易于访问和针在US上容易可视化,通常首选超声(US)进行实时引导 ( 90 )。然而,US图像的组织对比度低,可能包含由针引起的伪影,导致图像质量差 ( 67 )。MRI提供了更好的软组织对比度,并允许更容易地勾画OARs和靶区,尤其是当有显著的前列腺内病灶时 ( 15 )。因此,MR与US图像的配准结合了两种成像模态的优点。在妇科近距离治疗中,图像配准用于在剂量分次之间映射临床靶区,合并施源器重建的图像,促进剂量计算和肿瘤消退的跟踪 ( 91 )。图像配准的挑战来自几个因素:首先,图像之间可能发生解剖变形。例如,如果使用不同的成像模态在不同时间进行成像,由于膀胱充盈、肠道内容物或子宫位置的变化,器官可能看起来不同。此外,不同成像模态下器官可能呈现不同的信号,例如,在MRI上,膀胱比前列腺更亮,但这种强度差异在CT上并不明显 ( 28 )。这样的挑战使得手动配准成为一项繁琐的任务,因此,许多研究尝试使用深度学习等技术自动化医学图像配准 ( 92 , 93 )。
Zeng等人通过提出一种3-神经网络方法来解决这个问题,其中包括用于前列腺分割的全卷积神经网络(FCN),用于仿射配准的二维卷积神经网络(CNN),以及用于非刚性配准的U-Net。他们的方法的两个变体的平均DICE相似系数分别为0.89和0.91(31)。Chen等人(32)也使用3D V-Net和3D U-Net的组合来解决这一问题,并取得了最多0.87的DICE相似系数。这是在HDR放射治疗中针插入后将MR图像与US图像进行深度学习配准的第一项研究(32)。在HDR宫颈近距离治疗中,通常是以多个分次(例如3-5次)进行放射治疗,需要评估分次之间的剂量变化。Ecker等人尝试使用2D和3D神经网络自动化此配准步骤,并实现了从8.1到0.7的平均距离误差(针位置之间)(35)。
除了配准,人工智能还被应用于改善成像质量,无论是通过减少伪影还是将低分辨率图像转换为高分辨率图像。在2018年,Huang等人和Allman等人发表了关于应用人工智能减少图像伪影的主题。Huang等人应用基于残差学习的卷积神经网络来消除宫颈癌CT图像中的金属伪影。他们在测试集上达到了38.09 dB的峰值信噪比,并发现伪影去除所需时间少于1秒(36)。Allman等人构建了一个卷积神经网络来消除光声图像中的反射伪影,在水模体和模体数据集中实现了0.40±0.22 mm和0.38±0.25 mm的点源定位误差(33)。2020年,He等人应用生成对抗网络(GANs),即生成样本而不是分类样本的神经网络,将低分辨率TRUS切片精细化为高分辨率图像;他们实现了38.0±2.4dB的峰值信噪比(34)。
总之,使用人工智能进行图像处理和配准可能会提高图像质量,缩短时间,并增加结合不同图像模态的信心。这些改进可以提高放射治疗的速度和质量,特别是在基于US的工作流程中(该工作流程受组织对比度低和针伪影的影响),以及在其他因外部伪影而导致图像质量降低的环境中。
预计划是LDR放射治疗工作流程中常用的过程。在前列腺放射治疗中,这通常涉及使用经直肠US来确定前列腺和OAR的几何形状,以便放射剂量师与物理师和放射肿瘤学家协同工作,制定最大限度地提高前列腺剂量同时最小限度地暴露OAR的治疗计划(94)。在妇科近距离治疗中,预计划可能涉及施源器选择以及针位置和/或深度选择。除了自动化这个过程的速度和效率的明显优势外,AI算法与优化技术(如模拟退火、遗传算法)相结合非常适用于预计划应用中。
2017年,Nicolae等人提出了一个机器学习流程,其中包含k最近邻、有监督学习分类器和随机优化。随机优化是一类利用随机性来微调解决方案的技术,通过在训练数据库中识别相似的治疗计划并将该计划优化到新病例中,来自动化LDR前列腺射治疗预计划过程,从而适应新病人的解剖情况。定性地说,专家发现难以区分机器生成的计划和手工生成的计划(37)。2020年,他们通过一项I期随机对照试验验证了其算法产生的剂量计划与手动生成的治疗方案的非劣性(39)。最近,Aleef等人尝试使用生成对抗网络(GANs)解决自动化LDR前列腺近距离治疗整个预计划步骤的问题。他们使用条件GANs在170个病例上生成了方案,其中有90%被人类专家认为可接受(44)。然后,他们引入了他们的治疗计划GAN(TP-GAN),在150个病例上进行了测试,并发现得到的质量指标(例如PTV V100%,CTV V150%)与手工生成的方案基本相当(45)。这些团队所做的工作都表明利用人工智能可以加速端到端放射治疗计划的过程具有相当的潜力。早些时候对自主治疗计划的尝试使用了更传统的计算技术(41-43,49)。
除了自动化整个端到端的预计划流程外,一些论文还专注于将人工智能应用于预计划的各个步骤。Valdes等人使用基于决策树的机器学习模型识别出对挽救性放射治疗更有益的局部复发性前列腺癌患者。使用决策树机器学习技术,他们确定了两个可预测生化失败的特征、初始治疗与复发时间之间的无病间隔,以及复发时积极活检阳性率。Tian等人使用非线性支持向量机(SVM),一种传统的机器学习分类算法,识别高危患者中可能发生瘘的患者。然后可以根据这些计划进行调整,以预防插植放射治疗的这种罕见副作用。Boussion等人测试了许多经典的机器算法(例如SVM、多层感知器、XGboost),以预测从解剖特征中使用的最佳放射性粒子数量,用于LDR前列腺放射治疗。Stenhouse等人尝试了12种不同的经典机器学习算法,用于选择最佳的施源器(腔内或混腔内联合插植)用于宫颈癌HDR近距离放射治疗。他们表现最佳的模型是基于决策树的算法(例如AdaBoost、随机森林),利用的特征包括平均和最大纵横距离、体积和HR-CTV的轴向偏移等。他们最终的投票模型取得了90.6±1.1%的F1得分。
目前,机器学习已经被应用于前列腺近距离治疗的全流程预计划或者前列腺或宫颈近距离放射治疗过程中的个别步骤中,包括确定适合近距离治疗的患者、优化前列腺放射治疗使用的粒子数量,以及宫颈近距离放射治疗的施源器选择。大部分的预计划工作都是在前列腺癌近距离治疗方面进行的,而且仅限于单一机构的可行性研究。未来可能有机会将这些方法应用到宫颈癌近距离放射治疗中,以解决类似的优化问题。此外,更多的研究应该专注于在更大规模的多中心数据集上验证提议的机器学习流程,并进行前瞻性研究,以确保其泛化能力,并促进其在临床中的使用。
大多数高剂量率(HDR)近距离放疗工作流程不需要预计划,治疗计划是在术中完成。HDR计划可以基于2D或3D成像(有时也可以结合两者)。使用CT、超声或MRI来观察和勾画出施源器、靶区和危及器官(OARs)。与低剂量率(LDR)近距离放疗的预计划一样,HDR放疗的治疗计划旨在靶区获得最佳剂量的同时保护OARs(95)。
当前的HDR治疗计划方法包括逆向规划模拟退火(IPSA)和混合逆向治疗规划优化(HIPO)。IPSA和HIPO都是考虑患者解剖结构的优化策略,通过3D成像进行。IPSA使用模拟退火优化驻留时间,而HIPO使用替代确定性和随机方法。在某些软件中(Oncentra Prostate, Elekta),不仅可以逆向优化驻留时间,还可以优化针的放置(96)。这些过程类似于预计划中寻找放射源最佳位置的过程,因此也适合于人工智能的辅助。
在HDR前列腺癌近距离放疗中,治疗计划通常是在手术室实时完成的,这意味着通常会在实现最佳近距离放疗计划和使患者在麻醉下的时间保持最短之间存在一个权衡。这促使自动化预测最佳导管位置的出现。Lei等提出了一个3步流程,包括通过Reg-Net进行可变形配准、多图谱排序和导管回归。当在回顾性HDR前列腺癌近距离放疗计划中进行测试时,发现他们预测的导管位置与临床导管位置相比具有可比的剂量体积直方图(48)。这种方法最终可以减少对医生经验的依赖,标准化植入质量,但需要进一步的临床评估和验证。
最近,Pu等人使用深度强化学习,以深度Q网络作为主要技术,自动化HDR宫颈癌近距离放疗治疗计划。该算法生成的计划优于模拟退火生成的计划,因为它们在V150、V200和直肠、膀胱和乙状结肠的D2cc上较低,并具有更高的均匀性和一致性指数(52)。这让人想起Shen等人的工作,他们也将深度强化学习应用于HDR宫颈癌近距离放疗的逆向治疗计划。然而,Shen等人的工作不仅使用人工智能解决优化问题生成计划,还使用权重调整策略网络定义最佳优化问题的是什么。换句话说,他们的方法通过观察剂量体积直方图自动调整器官权重,类似于人类专家的行为。他们证明,与人工生成的计划相比,权重调整将生成计划的质量提高了10.7%,并根据其质量指标将优化为任意设置权重的计划的质量提升了8.5%(53)。
放置导管/源后治疗计划的关键步骤之一是计算最终剂量,包括计算剂量体积直方图和参数,如D90、V100、V150、V200等。Akhavanallaf等人提出了一种深度学习方法,具体是基于ResNet的架构,它是在Monte-Carlo生成的数据上进行训练来进行计算剂量(59)。与其他方法相比,包括AAPM TG-43,他们的方法对于真实剂量具有最小的偏差和方差。Mao等人使用了一种不同的深度学习技术,即3D细胞神经网络,与基于Ir-192的HDR近距离治疗的蒙特卡罗计算相比,提高了剂量预测的速度。他们的模型被称为Rapid Brachy DL,实现了明显更快且接近蒙特卡罗算法的剂量估计(60)。另一个小组,Villa等人,也使用细胞神经网络来预测给定源位置和器官轮廓的剂量分布。他们的算法往往低估了前列腺和直肠的剂量,高估了尿道的剂量,但总体而言,前列腺和尿道的卷积神经网络绝对平均误差低于2%,直肠的卷积神经网络绝对误差低于4%(51)。加州大学圣地亚哥分校的一个研究小组将基于知识的机器学习模型应用于宫颈近距离放射治疗的剂量预测(57,58)。在他们最近的工作中,他们报告了在他们的测试集上的评估,高危CTV的D90差异(实际减去预测)分别为-0.09±0.67 Gy,膀胱、直肠和乙状结肠的D2cc差异分别为-0.17±0.67、-0.04±0.46 Gy和0.00±0.44 Gy(54)。
人工智能可以促进的其他治疗计划过程包括由于分次内OAR变形而调整治疗计划和优化治疗参数。Jaberi等人使用多层感知器和径向基函数网络来预测妇科近距离放射治疗OAR的分次内剂量变化,并在医生指示的情况下提出新的计划(57)。他们的模型对膀胱、直肠、乙状结肠、中危CTV和高危CTV的平均百分比误差分别为6%、5%、8%、7%和10%。对于需要校正治疗计划的患者,他们的模型能够重新计算驻留时间,以减少错误的DVH参数的数量(例如,膀胱、直肠和乙状结肠的D90和D2cm3)。
上面的许多论文证明了人工智能可以帮助生成满足放射剂量参数列表的HDR治疗计划。这些放射剂量参数可以被视为毒性的代理。以结果为导向或以生物为导向的治疗计划是一种直接预测毒性而不使用剂量约束等代理的范例。这种治疗计划也可以通过人工智能来实现。Zhen等人尝试使用机器学习技术预测宫颈放射治疗患者的直肠毒性风险,使用CNNs实现了高达0.89的AUROC。一年后,他们采用了一个更简单的模型(SVM)与广泛的特征选择,将AUROC提高到0.91。Rajkovic等人使用神经网络和遗传算法建立了HDR前列腺放射治疗参数的模型,包括复发风险、治疗剂量和覆盖指数。具体而言,治疗剂量和覆盖指数被优化以使低风险和高风险前列腺癌患者的PSA最低点最小化。他们发现治疗剂量47.3 Gy和50.4 Gy分别适用于低风险和高风险患者。他们还发现,覆盖指数1.14和1.6分别适用于低风险和高风险患者,其中覆盖指数被定义为特定等剂量曲面覆盖的组织体积与前列腺平均体积的比率。这些参数对应于低风险和高风险患者的最PSA最低点分别为0.047和0.25 ng/cm 3。
总之,基于人工智能的剂量预测和治疗计划有可能提高HDR放射治疗计划的质量和速度。本节中介绍的论文使用人工智能来预测理想导管位置,生成治疗计划,在分次间调整计划并准确计算剂量。我们还介绍了生物驱动的治疗计划,这是基于人工智能的治疗计划的有前途的应用,因为剂量与结果之间存在复杂的关系。然而,需要注意的是,这些研究需要进一步验证。
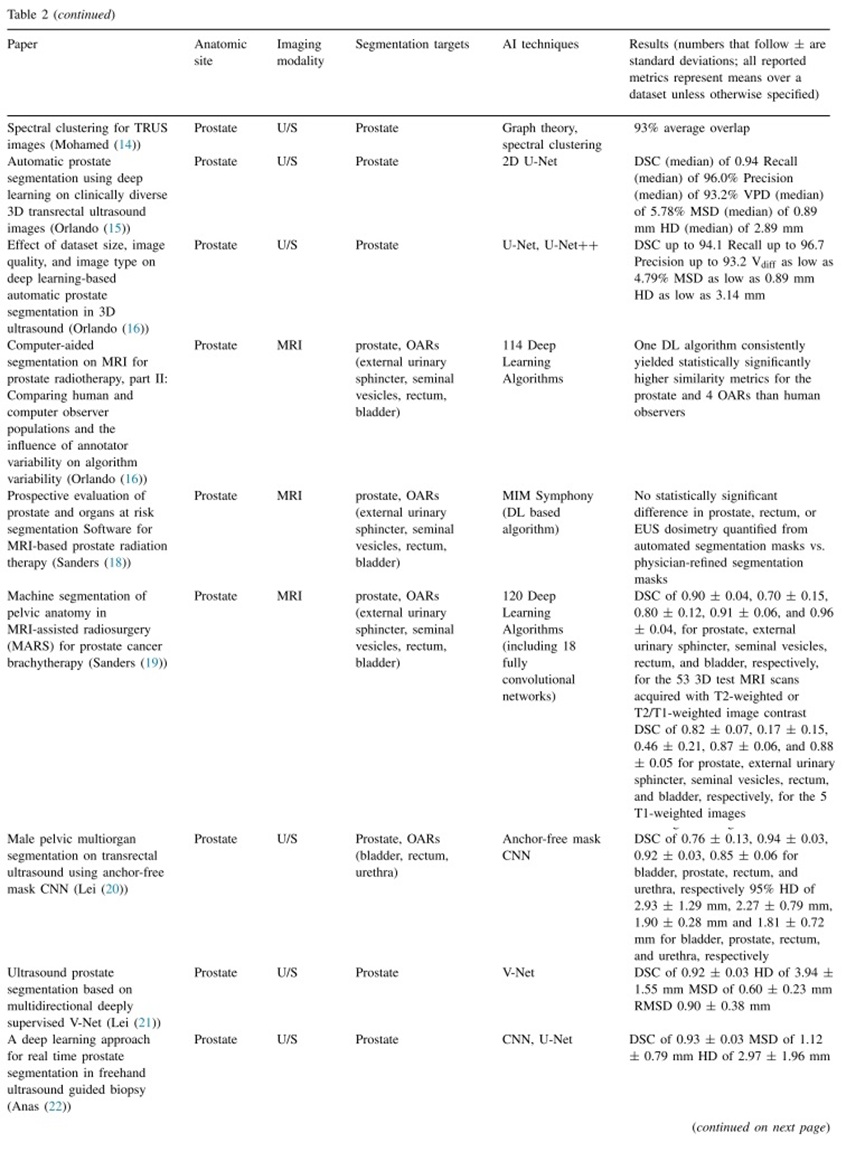
从成像模态中重建施源器、导管或针是一个关键步骤,因为准确的导管和源的位置决定了治疗计划的最终剂量。这在HDR放射治疗中尤为重要,因为有陡峭的剂量梯度。
重建可以分为两个步骤。第一步是通过定义施源器内部的源路径来重建施源器的几何形状,这是在施源器投入使用时执行的任务。第二步是通过将源路径相对于患者定位来合并施源器和解剖学结构的几何形状,可以通过使用施源器库(用户定义或供应商定义)或直接重建来完成,后者通常适用于针的重建。重建可以使用超声、CT、MR或多种成像模态的融合进行(97),通常由医学物理师完成。这个过程耗时,可能占据操作时间的一半,上述的第二步重建可能具有主观性。仅仅几毫米的施源器重建误差就可能导致剂量参数的显著偏离。因此,将人工智能应用于重建步骤是为了提高准确性、一致性和效率。
相对于大多数其他步骤,已经进行了更多的研究,以探索人工智能在促进或自动化HDR放疗工作流程中的潜力。其中大部分是最近发表的,并使用复杂且计算密集的深度学习技术。我们在表3中总结了这些研究。
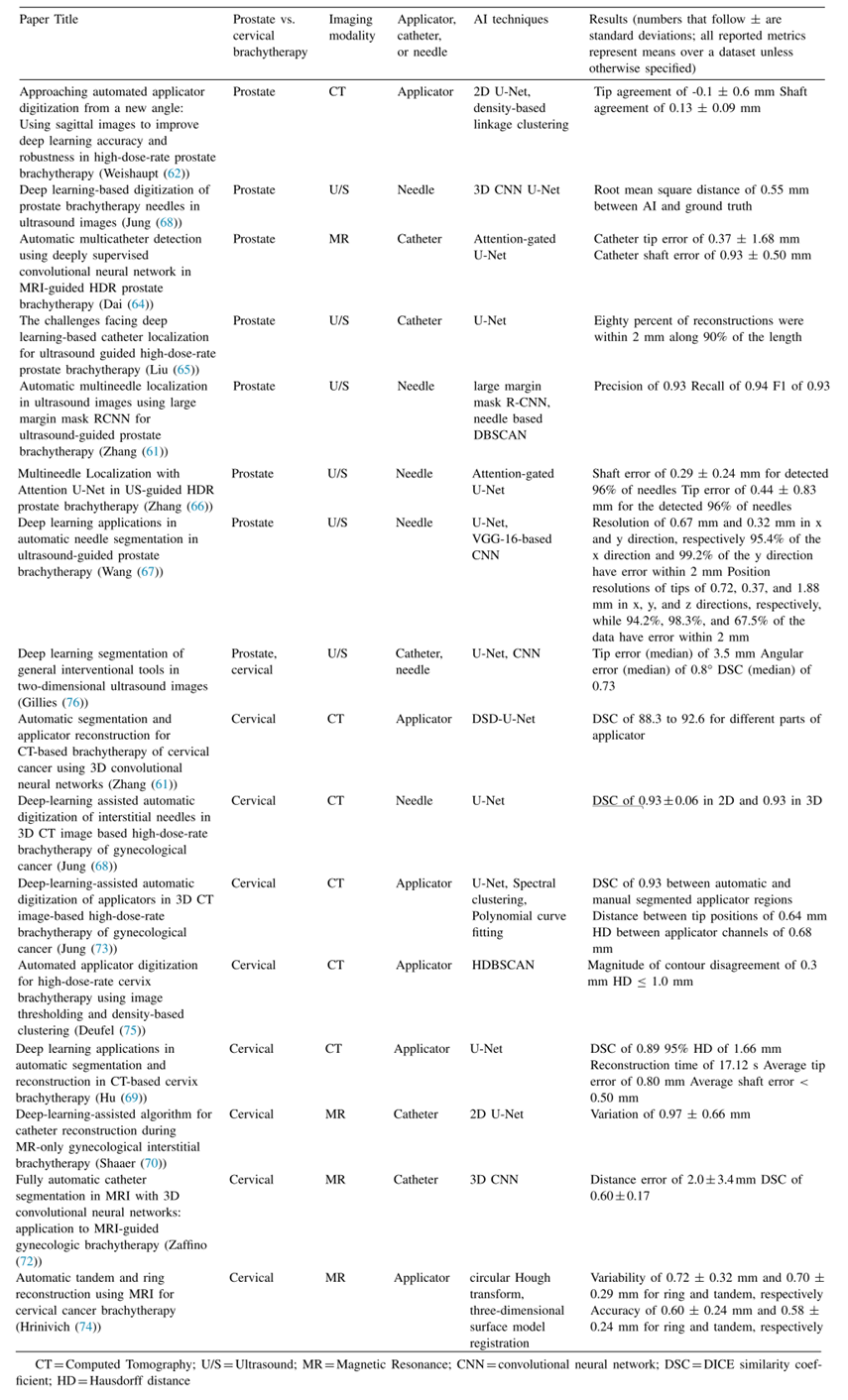
总体上,人工智能算法的重建性能与人类相当。然而,在几乎所有情况下,与人工重建相比,基于人工智能的重建显示出明显的速度提升。例如,Zhang等人提出的循环CNN花费约0.6秒来定位超声下的前列腺放疗患者的插植针,而经验丰富的医学物理师对于同样的任务可能需要长达20分钟。Hu等人的U-Net模型在大约17.1秒内为基于CT的宫颈放疗执行施源器重建,这大约是经验丰富的物理师所需时间的四分之一。
质量保证(QA)是放射治疗的一个关键组成部分,近距离治疗的QA程序与外照射放疗(EBRT)有很大区别。在永久性放射性粒子植入治疗中,包括剂量重构在内的许多QA程序是在植入后进行的,而在高剂量率(HDR)近距离治疗中,QA程序通常在术中进行。我们回顾了基于人工智能的质量保证在这两种情况下的新兴应用,并讨论了基于人工智能分析整个工作流程安全性的潜在应用。
在前列腺粒子植入治疗中,通常进行术后剂量测定来评估植入质量。有时是为了方便而在植入后立即进行,然而Orio等人证明30天后计算剂量可以发现由于前列腺水肿和粒子移位而导致显著的剂量变化。虽然CT可以清晰可见粒子,但轮廓受软组织对比度差的限制,导致剂量参数(如D90)波动较大。Crook等人显示第30天CT上的轮廓和剂量存在较高的观察者间变异性,并可能掩盖近距离治疗中的剂量–效应关系。建议通过MRI/CT融合验证术后前列腺轮廓。
正如在配准部分提到的,MRI具有最好的软组织对比度,但是粒子会显示为空洞,可能会被钙化所引起的空洞所混淆。理想情况下,MRI与CT的图像配准可以同时可视化器官和粒子,但Nosrati等人提出了一种替代的MRI-only工作流。他们使用定量磁敏感度映射来可视化粒子和钙化,使用磁化敏感度图来区分粒子和钙化,使用聚类来检测粒子位置。总体而言,在前列腺模体上测试时,该技术与基于标准CT的植入后剂量测定非常一致(77)。2019年,该团队进一步验证了他们技术的可行性,除了在模体上进行测试外,还在真实患者身上测试,并继续发现他们的算法能正确识别所有粒子(79)。2020年,他们将自己的方法与CT-MRI融合技术进行了比较,并发现计算得出的粒子位置和剂量参数之间没有显著差异(82)。
MD Anderson的另一个团队则使用一种名为SeedNet的滑动窗口CNN解决了LDR前列腺近距离治疗后的MR图像中粒子的识别问题。SeedNet在粒子检测方面达到了97.6%的识别率和97.2%的精确度,并且在粒子定位方面达到了0.19毫米的均方根误差。Nosrati等人和Sanders等人的工作共同展示了MRI替代CT进行术后植入剂量计算的潜力。与此同时,机器学习也被应用于自动定位传统使用的CT模态中的粒子。对于LDR前列腺近距离治疗,Younes等人使用贝叶斯分类和支持向量机等机器学习分类技术,在模拟图像上实现了1.09毫米的平均误差,在临床图像上实现了1.44毫米的平均误差,而Golshan等人则使用CNN在粒子定位上实现了78%的精确度(高于手动粒子定位),64%的识别率和70%的F1得分。
在HDR放射治疗中,Reijtenbagh等人(83)通过采用一种称为重叠容积直方图(Overlapping Volume Histograms,OVHs)的技术来研究生成的计划的质量,该技术已被用于检测EBRT中的低质量计划。机器学习模型被用于预测危及器官的D2cm3。该模型的平均方差范围在0.13到0.40 Gy之间。他们在阿姆斯特丹大学医学中心UMC Utrecht和Erasmus MC Rotterdam(EMC)收集的宫颈癌患者数据上测试了该技术。在EMC的一个患者群中,该技术确定了71个计划中的52个计划为异常值(即潜在质量较差),其中(52个计划中)12个计划被手动标记为符合协议,表明该技术在确定可能需要进一步优化的计划方面的效用。这项工作还凸显了基于人工智能的质量保证在多机构环境中突破单一机构工作流程并对计划进行基准测试的潜力。
虽然Reijtenbagh等人描述的基于知识的质量保证(QA)过程可以用来评估生成计划的质量,但其他团队研究了使用人工智能(AI)自动化交叉核对过程,该过程目前完全依赖人工。例如,Fan等人使用类似U-net的架构来预测驻留位置,并使用编码器网络来预测驻留时间。预测的驻留位置与计划的位置相差不超过一个像素,预测的驻留时间与实际值相差不超过2%(84)。
最后,除了在接受近距离治疗的个体患者中使用人工智能进行质量保证外,来自巴勒莫大学的一组人还研究了启发式技术在近距离治疗工作流的失效模式和错误风险分析中的应用。人为错误评估和减少技术(HEART)是一种评估工人在整个过程中出错概率的方法。Castiglia等人应用模糊逻辑来解决HEART方法的弱点,以估计不同的错误促成因素对近距离治疗期间人为错误的影响(85)。该小组还应用模糊逻辑来修改故障模式、影响和危险性分析(FMECA),这是另一种风险评估方法,以更好地解释人为错误。他们从分析中得出结论,错误的最常见原因是未能遵守程序、管理不当以及沟通和管理不力(86)。
这项研究总共找到了80篇论文,这些论文将人工智能工具应用于前列腺或宫颈放射治疗工作流程的不同步骤,包括分割、配准和图像处理、预计划、治疗计划、施源器/导管/针的重建以及质量保证。尽管迄今为止的大部分工作集中在分割方面,但从最近发表的论文数量来看,人工智能应用正在日益被探索用于放射治疗工作流程的所有步骤。人工智能算法在放射治疗工作流程的所有步骤上通常表现出与人类专家相当的最佳性能。然而,人工智能在工作流程中繁琐和耗时的步骤上往往能够提供极大的速度改进。附录中的补充表列出了每篇论文使用的硬件及在该硬件上运行每个人工智能算法所花费的时间(如果论文中提供了这些信息)。速度的提高,除了减少患者的麻醉时间外,还有助于促进近距离治疗的广泛应用。来自时间节约的工作流效率的任何改进都可能鼓励在资源投入较少的使用这种技术。
在分割部分,许多论文探讨了AI如何用于靶区和危及器官的分割。在这个应用领域中,最常用的技术是CNN,特别是U-Net架构,这最初是用于生物医学分割的(104)。施源器/导管/针的重建可以看作是分割的一种特殊情况,所以不足为奇,这个应用领域主要探索的技术再次是U-Net架构。在配准和图像处理部分,使用深度学习技术自动化配准和去除图像伪影的论文。由于这些任务与分割类似,所以这里最常用的技术仍然是CNN,包括U-Net和V-net架构。在预计划部分,研究小组试图自动化端到端的预计划,并将AI应用于预先规划过程的特定步骤,例如预测最佳导管使用情况,预测最佳粒子数量,或者识别更容易发展严重毒性的患者。在这一部分中,许多使用的AI技术是非深度学习技术,如基于决策树的建模、支持向量机和K最近邻算法,尽管来自不列颠哥伦比亚的一个研究小组使用GANs自动化了端到端的预计划。在HDR腔内近距离治疗计划中,AI被用于生成计划、调整AI技术,包括深度强化学习、CNN和SVM。最后,在质量保证部分,AI被用于计算植入后剂量、定位植入后的粒子、检测低质量的计划和评估错误计划的可能性。在工作流程的这一步中,主要使用的技术有SVM、贝叶斯分类、CNN和模糊逻辑。
我们的搜索策略的一个局限性是很多论文提出了可以应用于放射性治疗工作流程的通用人工智能技术,但可能并未明确提到近距离治疗。例如,许多前列腺分割算法在旨在外照射治疗或前列腺活检的论文中进行了描述。然而,没有使用放射治疗数据来验证其算法的论文未被包括在本文中。许多这样的论文可以在Fechter等人(105)的论文中找到。因此,本文通过文献综述得出的适用于放射治疗的人工智能研究数量被低估了。
虽然我们相信人工智能在增强和自动化放射治疗领域具有巨大潜力,但在这篇综述中总结的论文中存在一些普遍的缺点,即报告质量和方法学质量的差异。确定人工智能程序在放射治疗工作流程的不同步骤中表现如何的一个挑战是因为人工智能论文中的报告差异。例如,并非所有论文都报告他们研究中使用的样本大小。最低限度上,我们建议未来放射治疗领域的人工智能论文应遵守标准的报告指南,如MI-CLAIM (106)、TRIPOD-AI (107)和STARD-AI (108)。
此外,对这些报告指南中的某些标准应进行澄清,以使其适用于近距离治疗领域。我们提出以下建议。在报告TRIPOD-AI项目的5c项目(治疗详细信息)时,近距离治疗论文应具体说明患者已接受的治疗。对于宫颈近距离治疗,这包括EBRT分割/剂量和治疗方式(四野,VMAT等)。对于前列腺近距离治疗,论文应具体说明近距离治疗是在EBRT之后还是之前进行的。这还包括使用的设备,即施源器/针的供应商,针的规格,组成(例如,带针芯的塑料针与钛针),施源器类型以及其他干预措施(例如,直肠导管,Foley球囊等)。
在报告TRIPOD-AI的第9项(缺失数据处理)时,近距离放射治疗论文应该说明如何使用不完整的数据。特别是,我们认为需要特别关注如何报告AI的性能(TRIPOD-AI的第16项)。图表2和图表3清楚地显示了性能报告不统一的情况。如果两篇提出用于相同任务的AI算法的论文使用不同的性能度量标准,则很难进行比较。此外,很难评估技术性能度量(例如DICE分数)的临床价值。除了报告不一致的问题,本文确定的研究质量也不稳定。本文中大部分研究的样本量都小于50。附录中的补充表列出了每篇论文中使用的样本量。部分原因可能是近距离放射治疗数据的稀缺性。
此外,有些研究没有单独的外部验证集,仅使用了留一法交叉验证或k倍交叉验证。为了解决报告的可变性,我们建议未来的放射治疗人工智能论文遵循人工智能报告指南,标准化性能报告,并使用与人工专家性能比较相一致的临床相关指标。我们还希望倡导更大规模的多中心前瞻性试验,而不是仅依赖于缺乏独立测试集的单一机构可行性研究。多中心研究可以使不同中心认识到它们实践中的差异,而强大的人工智能模型应该能够推广到从不同中心收集的数据。
尽管近距离放射治疗中的人工智能是一个新兴领域,但它发展迅速。我们建议未来的研究应通过遵循TRIPOD-AI等指南来标准化其报告。特别是,我们强调以临床可解释的方式报告结果的重要性,例如与人类专家的性能比较。我们还主张进行更大规模的多中心研究,包括更多的参与者,以提高推广性。尽管这个领域还需要更多的工作,但我们相信人工智能在促进、自动化和/或加速近距离放射治疗的许多组成部分方面具有很大潜力。
关注公众号“brachytherapy”回复“人工智能”获取PDF原文。